Wasserstoffperoxid (H2O2) ist gemeinhin als Bleich- und Desinfektionsmittel bekannt. Aber auch in lebenden Zellen wird es ständig produziert. Oft als Nebenprodukt von biologischen Prozessen, manchmal auch absichtlich, um Pathogene abzutöten. Es wird zudem vermutet, dass H2O2 als Signalmolekül eine wichtige Rolle spielt. Um diese Funktion zu ergründen, haben Forschungsteams der TU Kaiserslautern (TUK) und der Universität des Saarlandes einen H2O2-empfindlichen Sensor für pflanzliche Zellen entwickelt. Dieser macht sichtbar, wo in der Zelle Wasserstoffperoxid produziert wird und wie die Signalwege verlaufen. Die Arbeit ist im renommierten Fachmagazin „The Plant Cell“ erschienen.
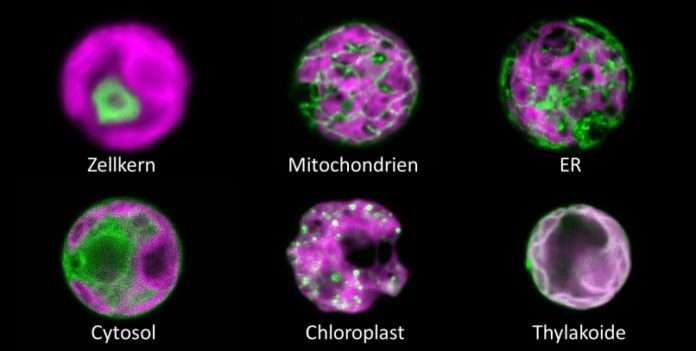
Professor Dr. Michael Schroda, der an der TUK den Lehrstuhl für „Molekulare Biotechnologie und Systembiologie“ innehat, erläutert: „Wir haben einen hypersensitiven H2O2-Sensor für die einzellige Grünalge Chlamydomonas reinhardtii entwickelt. Er basiert auf einer Variante des grün fluoreszierenden Proteins, genannt roGFP2, gekoppelt an eine Peroxidase. Der Trick ist nun, dass die Peroxidase sehr effizient durch Wasserstoffperoxid oxidiert wird und diese sofort roGFP2 weiteroxidiert, welches dadurch seine fluoreszierenden Eigenschaften ändert. Dies erlaubt, Änderungen der H2O2-Konzentration in der lebenden Zelle auszulesen. Wir haben den Sensor nachfolgend in sechs verschiedene Zellkompartimente eingebracht und die H2O2-Konzentrationen, die wir durch wechselnde Umweltbedingungen wie Licht- oder Hitzestress induziert hatten, in Echtzeit verfolgt. So konnten wir zum Beispiel zeigen, dass Chloroplasten unter starker Lichteinstrahlung H2O2 produzieren. Dieses diffundiert ins benachbarte Cytosol, aber nicht weiter in den Zellkern, weil es unterwegs abgebaut wird.“
Der kürzlich im Fachmagazin „The Plant Cell“ erschienene Forschungsartikel resultiert aus einer wissenschaftlichen Teamleistung: Die Arbeitsgruppe von Michael Schroda hat ihre Kompetenzen mit denen von Professor Dr. Bruce Morgan von der Universität des Saarlandes sowie denen von Dr. David Scheuring aus dem Fachgebiet Phytopathologie an der TUK gebündelt. „Bruce Morgan hat sein Wissen um das in Hefe etablierte Sensorprotein ins Projekt gebracht; David Scheuring hat uns geholfen, mit modernster Mikroskopie-Technik die Produktion und Verteilung von H2O2 in den Algenzellen sichtbar zu machen“, sagt Schroda. „Meine Arbeitsgruppe hat mittels gentechnologischer Methoden den Weg dafür geebnet, dass wir das Sensorprotein in spezifische Kompartimente der Algenzelle einbringen und den Einfluss der wechselnden Umweltbedingungen nachvollziehen konnten.“
Das erfolgreich validierte Sensorsystem ist ein Produkt der synthetischen Biologie – entwickelt von Forschern für Forscher. „Das System ist modular, wie ein Baukasten mit Legosteinen“, führt Schroda aus. „Indem wir Gene in kleine Funktionseinheiten zerlegen und definierte Steckverbindungen hinzufügen, lassen sich die Einheiten beliebig kombinieren und im Handumdrehen genetische Schaltkreise für unsere Forschungszwecke aufbauen.“ Das in den Ingenieurswissenschaften lange bekannte Prinzip normierter Bauteile sorgt so für wissenschaftlichen Fortschritt in der Biologie.
Die Original-Veröffentlichung im Fachmagazin „The Plant Cell“ ist unter dem folgendem Link einsehbar: https://academic.oup.com/plcell/advance-article/doi/10.1093/plcell/koab176/6312563
https://doi.org/10.1093/plcell/koab176
Fragen beantwortet:
Quelle Text/Bild:
TU Kaiserslautern
Hochschulkommunikation
Gottlieb-Daimler-Straße 47
67663 Kaiserslautern
www.uni-kl.de
Kaiserslautern: 19.08.2021


















 und dann
und dann